zurück zur Startseite
Grundlagen zum Aufbau von Gasen
1.1.1.Mikrophysikalischer Aufbau eines Gases
Betrachtet wird im folgenden ein Ausschnitt eines mit Gas gefüllten Rohres.

Thermische Bewegung von Gasatomen oder Molekülen
Ein Gas besteht aus isolierten, atomaren oder molekularen Teilchen, die sich unter Normalbedingungen mit einer relativ großen Geschwindigkeit in alle Richtungen bewegen und beständig miteinander oder mit der Wandung des Behälters zusammenstoßen.

Thermische Bewegung von Gasatomen oder Molekülen
1.1.2.Daten über Luft bei Zimmertemperatur
Luft besteht aus einer Mischung von etwa 20% Sauerstoffmolekülen O2 und 80% Stickstoffmolekülen N2.
Bei Zimmertemperatur und normalem Luftdruck beträgt die mittlere Geschwindigkeit dieser Sauerstoff- bzw. Stickstoffmoleküle etwa 480 m/s. Die mittlere Zahl der Zusammenstöße eines Moleküls liegt in der Größenordnung von 108 pro Sekunde. Die mittlere, freie Weglänge zwischen zwei Zusammenstößen liegt in der Größenordnung von 6 x10-8 m.
1.1.3.Druck und Dichte
Die physikalische Größe "Druck" kennzeichnet einen Zustand, bei dem eine Kraft auf eine bestimmte Fläche einwirkt. Sind die Größe der Kraft F und der Fläche a bekannt, so wird die Größe des Drucks angegeben als F/a.
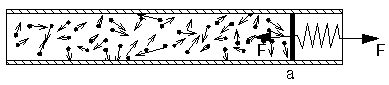
Druck auf eine Wand, verursacht durch aufprallende Teilchen
Um die Fläche an der Position a, die beständig einseitig von den Gasteilchen getroffen wird, im Gleichgewicht zu halten, sei die Kraft F erforderlich. Dann ist der Druck auf diese Fläche P = F/a.
Der Druck in einem Gas wird durch die Zahl der Atome oder Moleküle hervorgerufen, die pro Zeiteinheit auf die vorgegebene Fläche auftreffen. Diese Zahl ist proportional zur Dichte des Gases, also zur Zahl der Teilchen pro Volumeneinheit. Der Druck ist weiterhin abhängig von der mittleren, thermischen Geschwindigkeit der mikrophysikalischen Teilchen.

Druck auf eine Wand, verursacht durch aufprallende Teilchen
T1.1.4.hermische Geschwindigkeit und Gleichverteilung
Die Temperatur eines Gases wird mikrophysikalisch erklärt durch die statistisch-ungeordnete Bewegung seiner Atome bzw. Moleküle.
Je höher die mittlere Geschwindigkeit der Moleküle, desto höher die Temperatur des Gases. Durch diese thermische Bewegung und die große Zahl der Zusammenstöße wird bewirkt, dass sich die Moleküle gleichmäßig in dem zur Verfügung stehenden Raum verteilen.
Eine solche Gleichverteilung kann nur durch äußere Einflüsse gestört werden. Ohne äußere Einwirkungen bleibt diese thermische Gleichverteilung bestehen. Bleibt nach einer äußeren Störung das System sich selbst überlassen, so stellt sich auf Grund der statistisch-ungeordneten Bewegung der Atome bzw. Moleküle stets wieder eine Gleichverteilung ein.
1.1.5.Driftgeschwindigkeit
Von der thermischen Geschwindigkeit der Gasmoleküle ist eine andere Art der Bewegung zu unterscheiden, die zu einer gleichmäßigen Strömung des Gases führt. Hierbei erhalten die Teilchen alle die gleiche Driftgeschwindigkeit mit gleicher Orientierung. Diese Driftgeschwindigkeit bezieht sich auf eine Bewegung, die alle Gasteilchen innerhalb eines Leitungsabschnittes gemeinsam ausführen und die somit makroskopisch zu beobachten ist.
Die Driftgeschwindigkeit und die thermische Geschwindigkeit überlagern sich.
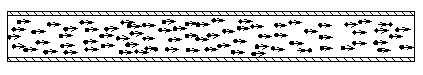
Darstellung einer gleichmäßigen Strömung
(ohne Kennzeichnung der thermischen Geschwindigkeit)
Die Driftgeschwindigkeit ist in aller Regel deutlich kleiner als die thermische Geschwindigkeit und liegt im Bereich von einigen mm/s bis m/s.
Die durchschnittliche thermische Geschwindigkeit von Sauerstoff- oder Stickstoffmolekülen liegt unter Normalbedingungen bei etwa 450 m/s.

Darstellung einer gleichmäßigen Strömung
(ohne Kennzeichnung der thermischen Geschwindigkeit)
zurück zur Starseite